May 25, 2019 Pageview:439
Hasta ahora, no existe un electrolito completamente ideal para las baterías de litio. Los electrolitos orgánicos más comúnmente utilizados en la actualidad son la alta conductividad iónica y un amplio rango de temperatura. El desarrollo de nuevos electrolitos es imperativo porque es fácil incendiarse y provocar accidentes de seguridad. El desarrollo de nuevos electrolitos requiere una teoría confiable que lo respalde, pero debido a que el electrolito involucra más factores que influyen (como viscosidad, concentración de sal, disolución, asociación de iones e interacción ion-solvente), el mecanismo de migración de los iones no es muy claro. Entonces, ¿cómo migran los iones de litio en electrolitos orgánicos, electrolitos sólidos y electrolitos líquidos iónicos?
Primero, el electrolito orgánico
El electrolito actúa como un portador dentro de la batería de litio, que proporciona una ruta de transporte para el transporte de iones entre los materiales positivos y negativos. Simplemente tomando el proceso de carga como ejemplo, se elimina Li + del material activo positivo y se reduce la concentración de Li + en la superficie de las partículas de fase sólida del electrodo positivo, de modo que se produce una diferencia de concentración entre el interior y la superficie de la partícula, de modo que el Li + genera partículas que se difunden desde el interior hacia el exterior. Al mismo tiempo, el Li + generado por la reacción electroquímica en la superficie de las partículas ingresa al electrolito y la concentración local de la región de la interfaz en la fase de solución aumenta, lo que provoca una diferencia en la concentración dentro de la fase de solución, lo que resulta en difusión y migración. de Li + desde el interior hacia el exterior. En la región del electrodo negativo, dado que las partículas del electrodo negativo reaccionan electroquímicamente con Li + en el electrolito, el Li + en la fase de solución se consume y la concentración de Li + en la fase de solución se reduce, lo que resulta en una diferencia en la concentración, lo que resulta en difusión y migración. de Li + del exterior al interior en la fase de solución.
Al mismo tiempo, se produce una reacción electroquímica en la superficie de las partículas del electrodo negativo, y el Li + se intercala para provocar una diferencia en la concentración dentro de las partículas, lo que hace que el Li + se difunda desde el exterior hacia el interior de las partículas. En el separador, debido a la diferencia de concentración causada por los electrodos positivo y negativo, Li + en esta región causa difusión y migración desde el electrodo positivo al electrodo negativo, y el proceso de descarga es opuesto al proceso anterior. Puede verse en el proceso anterior que el funcionamiento normal y eficiente de la batería de litio está determinado principalmente por la migración de iones de litio dentro de la batería. La migración de iones de litio está restringida por las propiedades del electrolito, y las propiedades del electrolito se ven afectadas principalmente por los siguientes factores.
1. Disolución de la sal de litio
El electrolito consta de un soluto y un solvente. El soluto se selecciona generalmente de un líquido de una combinación de una pluralidad de disolventes orgánicos. Cuando se disuelve LiPF6 en el disolvente, se forman iones de litio e iones negativos de PF6. La disolución de la sal de litio está estrechamente relacionada con la constante dieléctrica del disolvente, y cuanto mayor es la constante dieléctrica, más fuerte es la solubilidad de la sal de litio. Cuando los iones de litio están completamente rodeados por moléculas de solvente, el efecto de los iones negativos sobre los iones de litio se debilita, se produce la llamada disolución. Para las sales de litio, cuanto más grande es el anión, mejor es la conductividad iónica del electrolito y su propia disolución, porque cuanto más grande es el anión, más fácil es dispersar su carga negativa y evitar el apareamiento de cationes.
2. Viscosidad del electrolito
La viscosidad del electrolito tiene un efecto importante sobre el movimiento de los iones, y cuanto menor es la viscosidad, más favorable es el movimiento de los iones.
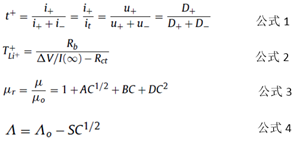
Los iones de litio se transportan y transfieren bajo la influencia de la disolución y viscosidad del líquido del electrodo. En la fórmula 1, t + es el número de transportes, i + e i- representan la corriente formada por el catión y el anión, respectivamente, representa la corriente total, u ± representa la movilidad del anión y el catión, y D ± representa la coeficiente de difusión del anión y del catión.
De hecho, la resistencia iónica no solo está relacionada con el anión y el catión, sino también con el disolvente. El número de migraciones de iones se puede expresar mediante la Ecuación 2:
Entre ellos, TLi ++ representa el número de migración de iones de litio, Δ V es el voltaje de polarización, I ( ∞ ) es la corriente de estado estable después de la polarización, y Rb y Rct son la resistencia a granel y la resistencia a la transferencia de carga.
Es difícil que el electrolito del sistema disolvente de una sola fase tenga tanto alta conductividad como baja viscosidad. Por lo tanto, el solvente de electrolito comúnmente utilizado está formulado por una variedad de solventes, como un electrolito binario. (Sal de litio) + (1-w) (disolvente A) + w (disolvente B), la unidad m de sal de litio es generalmente una concentración molar, mol / kg, yw es la fracción de masa del disolvente. Para los electrolitos unitarios, no existe una teoría confiable para predecir la viscosidad y la conductividad iónica del electrolito. Jones – Dole (JD) y Debye – Hückel – Onsager (DHO) han propuesto dos fórmulas empíricas, Ecuación 3 y Ecuación 4:
Donde μr es la viscosidad relativa, μ es la viscosidad de la solución, μ0 es la viscosidad del solvente puro, C es la concentración de sal de litio, A, B y D son coeficientes, Λ es la conductividad molar y Λ0 es la conductividad molar en el estado de dilución infinita. S es un parámetro que se ve afectado por las propiedades físicas del solvente y las propiedades del electrolito, y C es la concentración del soluto. La fórmula empírica también debe modificarse si cambian los tipos de sales de litio y disolventes. Para electrolitos mixtos, la fórmula es más compleja.
Por lo tanto, cuando se configura un nuevo electrolito multicomponente, es necesario probar el rendimiento del electrolito para determinarlo y no se puede realizar la estimación previa. Aunque la conductividad iónica tiene una gran influencia en el rendimiento de la batería, otros factores como la formación y el rendimiento de SEI también son factores muy críticos, y también se deben considerar la estabilidad, toxicidad y similares del electrolito a gran aumento. En resumen, todos los factores relacionados con la aplicación de producción real deben considerarse antes de considerar los parámetros de conductividad iónica.
Segundo, electrolito sólido
En comparación con los electrolitos orgánicos líquidos, los electrolitos sólidos tienen mayores ventajas para las baterías de litio, como diseño simple, empaque conveniente, buena resistencia a golpes y vibraciones, buena resistencia a temperatura y presión, estabilidad electroquímica y amplio rango y seguridad. Buen sexo y así sucesivamente. Sin embargo, la conductividad iónica de los electrolitos sólidos es relativamente limitada. En general, los electrolitos sólidos se pueden clasificar en polímeros en gel, polímeros sin disolventes, compuestos de cristales inorgánicos, materiales de vidrio inorgánicos y similares. Dentro del compuesto cristalino inorgánico, la conducción de iones de litio se debe a la migración de iones móviles entre los sitios favorables de energía del potencial circundante, y el movimiento de los iones circundantes proporciona energía de activación para que los iones en movimiento los hagan pasar. los canales en la estructura cristalina.
El mecanismo de transporte de iones del electrolito polimérico es diferente del del compuesto cristalino inorgánico y del electrolito líquido. En los electrolitos poliméricos sin disolventes, la movilidad de los iones se ve afectada por el movimiento del material polimérico anfitrión. Los iones se mueven solo cuando el segmento de polímero experimenta un movimiento de amplitud considerable asociado con la temperatura de transición vítrea (Tg). El electrolito polimérico presenta una conductividad iónica rápida a una temperatura superior a la temperatura de transición vítrea Tg, en cuyo caso el electrolito polimérico se compone principalmente de una fase amorfa. Por lo tanto, un polímero que tiene una temperatura de transición vítrea baja Tg como PEO (Tg-50 a -57 ° C) se ha convertido en un importante anfitrión polimérico de un electrolito sin solvente, y se está estudiando la amorfización del polímero como una forma de aumentar su iónico. conductividad. . Los electrolitos de polímero de tipo gel exhiben una conducción de iones más rápida que los electrolitos sin solvente debido a la difusión de solventes de bajo peso molecular en el polímero y al movimiento de los segmentos de polímero.
Tomando PEO como ejemplo, el mecanismo de transporte de electrolitos de este tipo de polímero es como se muestra en la figura anterior. Después de la electrificación, el movimiento segmentario de la parte amorfa del polímero conduce al proceso repetitivo del proceso de “descomplejación-recombinación” de Li +. Logre una migración rápida.
Los electrolitos sólidos basados en la tecnología de película delgada desarrollados en la industria de los semiconductores se han estudiado intensamente como componentes clave de las microbaterías de estado sólido. El costo de la mayoría de los electrolitos cristalinos y vítreos desarrollados para microbaterías es demasiado alto debido a los largos tiempos de síntesis y las condiciones de alta temperatura en el proceso de fabricación. Además de estas desventajas, los materiales inorgánicos para electrolitos sólidos generalmente contienen metales costosos como Ge, Ti, Sc, In, Lu, La e Y.Los electrolitos de polímero de tipo gel han tenido éxito comercial debido a las dificultades encontradas para amplificar y aplicar la mayoría de los electrolitos sólidos.
En tercer lugar, electrolito líquido iónico
Otra clase de materiales que se consideran electrolitos es el líquido iónico. La definición de líquido iónico no está clara actualmente, y generalmente se considera que es un líquido compuesto completamente por cationes y aniones, que es una sal orgánica líquida a temperatura ambiente o cerca de la temperatura ambiente. Los líquidos iónicos tienen propiedades únicas que incluyen no inflamabilidad, baja presión de vapor, alta estabilidad térmica, buena estabilidad electroquímica, baja toxicidad y alto contenido de iones.
Generalmente, los líquidos iónicos se clasifican en tres tipos: un líquido iónico de tipo AlCl 3, un líquido iónico de tipo no AlCl 3 y un líquido iónico especial. Las propiedades fisicoquímicas de varios líquidos iónicos se pueden encontrar en la literatura pertinente. En general, la viscosidad del líquido iónico es de uno a dos órdenes de magnitud mayor que la del electrolito líquido, por lo que la conductividad iónica es de tres a cuatro órdenes de magnitud menor que la conductividad iónica del electrolito líquido. La ley de Walden se usa comúnmente para la relación entre conductividad y viscosidad de líquidos iónicos, expresada de la siguiente manera:
λi es la conductividad iónica de la especie iónica i, y μ es la viscosidad.
Debido a que la viscosidad está determinada en gran medida por la interacción de influencias tales como interacciones de van der Waals, grados de libertad conformacional, fuerzas de coulomb y formas de iones, los investigadores han realizado esfuerzos considerables para estudiar la interacción de sustancias iónicas en líquidos iónicos. Además de la baja conductividad iónica, es poco probable que los electrolitos líquidos iónicos formen capas de SEI en los materiales del ánodo de carbono, lo que da como resultado el agotamiento de los iones Li circulantes. Por lo tanto, en muchos casos, los líquidos iónicos requieren aditivos para su uso como electrolitos.
La página contiene el contenido de la traducción automática.
 Dejar un mensaje
Dejar un mensaje



Nos pondremos en contacto con usted pronto